样品中大肠菌群的检验
一、实验材料
1.仪器: 36±1℃温箱、天平、显微镜、平皿、44±0.5℃水浴、试管、吸管、载玻片
2.培养基及试剂:乳糖胆盐发酵管、伊红美兰琼脂培养基、乳糖发酵管、革兰氏染色液、芽孢染色液
二、基本原理
大肠菌群系指一群在37℃24小时能发酵乳糖、产酸、产气需氧和兼性厌氧的革兰氏阴性无芽孢杆菌。该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,具有广泛的卫生学意义。
食品中大肠菌群数系以每l00ml(g)检样内大肠菌群最可能数(MPN)表示。
三、检验程序
大肠菌群检验程序如下:
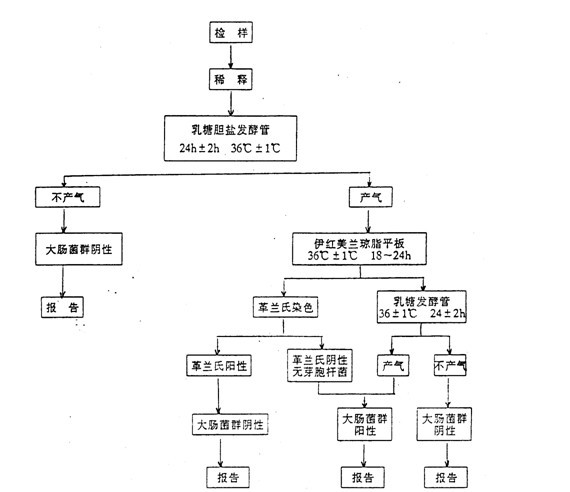
四、操作步骤
1.检样稀释
(1)以无菌操作将检样25ml(或25g)放于含有225ml灭菌生理盐水或其他稀释液的灭菌玻璃瓶内(瓶内预置适当数量的玻璃珠)或灭菌乳钵内,经充分振摇或研磨作成1:10的均匀稀释液。固体检样最好用均质器,以8000~10000r/min的速度处理/min作成1: 10的均匀稀释液。
(2)用1ml灭菌吸管,吸取1:10稀释液1ml,注入含有9ml灭菌生理盐水或其他稀释液的试管内,振摇试管混匀,作成1:100的稀释液。
(3)另取1ml灭菌吸管,按上项操作依次作10倍递增稀释液,每递增稀释一次,换用1支1ml灭菌吸管。
(4)根据食品卫生标准要求或对检样污染情况的估计,选择三个稀释度,每个稀释度接种3管。
将待检样品接种于乳糖胆盐发酵管内,接种量在1ml以上者,用双料乳糖胆盐发酵管, 1ml及1ml以下者,用单料乳糖胆盐发酵管。每一稀释度接种3管,置36±1℃温箱内,培养24 ±2h ,如所有乳糖胆盐发酵管都不产气,则可报告为大肠菌群阴性,如有产气者,则按下列程序进行。
2.分离培养
将产气的发酵管分别转种在伊红美兰琼脂平板上,置36±1℃温箱内,培养18~24h,然后取出,观察菌落形态,并作革兰氏染色和芽孢染色以及证实试验。
3.证实试验
在上述平板上,挑取可疑大肠菌群菌落1~2个进行革兰氏染色,同时接种乳糖发酵管,置36±1℃温箱内培养24±2h,观察产气情况。凡乳糖管产气,革兰氏染色为阴性的无芽孢杆菌,即可报告为大肠菌群阳性。
4.报告
根据证实为大肠菌群阳性的管数,查MPN检索表,报告每100ml(g)大肠菌群的最可能数。